2019年5月20日,中国医学科学院基础医学研究所&华中科技大学同济医学院黄波教授、华中科技大学生命科学与技术学院、国家纳米药物工程技术研究中心杨祥良教授、甘璐教授团队合作在Nature Biomedical Engineering杂志在线发表研究论文The softness of tumour-cell-derived microparticles regulates their drug-delivery efficiency,制备了TRCs来源的囊泡(3D-MPs),利用该囊泡负载药物时具有更强的抗肿瘤效果。
Nature Biomedical Engineering (《自然-生物医学工程》)是《自然》杂志2017年新增的子刊,该刊横跨生命科学、自然科学和工程学,涵盖材料、治疗方法和器材等领域,旨在理解、诊断或改善各种临床和卫生背景下的人类健康问题。

黄波,载药囊泡治疗肿瘤技术发明人。中国医学科学院基础医学研究所&北京协和医学院“协和学者”特聘教授,博士生导师,同时系华中科技大学同济医学院生物化学与分子生物学系教授、博导。国家杰出青年科学基金获得者,长江学者特聘教授,科技部中青年科技创新领军人才,国家百千万人才工程入选者,万人计划入选者。作为通迅作者在国际知名学术期刊发表60余篇论文,30多篇论文影响因子> 5.0,总引用次数达3500余次。
癌症化疗中,药物在肿瘤细胞中浓度过低,系统性毒理反应是当前临床癌症化疗面临的主要困境【1,2】。
纳米药物由于具有渗透与滞留增强效应(EPR)、智能响应性、可靶向修饰、不同作用机制药物共输运等优势,在肿瘤精准治疗和诊疗一体化方面受到极大关注。尽管基于纳米技术的药物递送系统可以提高药物对肿瘤细胞的渗透能力,但是依旧存在药物无法充分在肿瘤细胞的位置富集,无法充分渗透到肿瘤软组织中等一系列棘手的问题。
除此之外,与实体瘤肿瘤血管相隔甚远的缺氧隔层中存在着高致瘤性的肿瘤再生细胞(tumor-repopulating cells, TRCs)。 而传统的纳米药物递送系统很难将药物靶向到这些肿瘤再生细胞中【3,4】,如何进一步提高抗肿瘤纳米药物的靶向输送效率和临床治疗效果仍面临诸多挑战。
囊泡(又称微颗粒,Microparticles, MPs)是细胞受到刺激或者凋亡时释放的一种100-1000 nm的囊泡结构,由于生物相容性高、免疫原性低、靶向性等特点可用做药物的载体。有研究表明,将肿瘤细胞来源的囊泡用于化疗药物的递送会有更好的癌症治疗效果,同时几乎没有副作用和不良反应【5,6】。
黄波教授课题组早在2009年在国际上率先对肿瘤细胞来源囊泡负载抗肿瘤药物展开研究,证实其具有良好的抗肿瘤效果,并已应用于临床。
本研究利用黄波教授与汪宁教授课题组发展的软三维纤维蛋白胶筛选、培养肿瘤再生细胞(tumor-repopulating cells, TRCs)技术,制备了TRCs来源的囊泡(3D-MPs)。
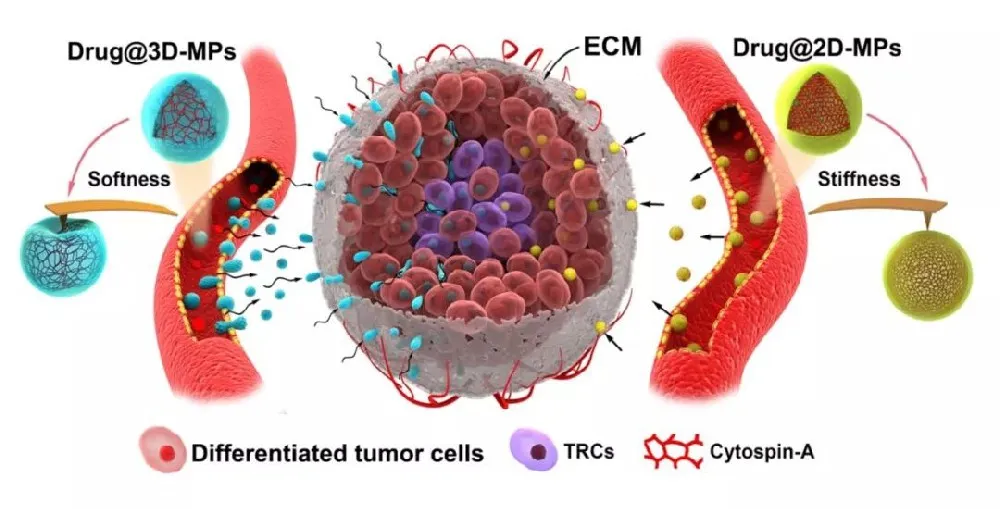
与普通肿瘤细胞来源囊泡(2D-MPs)相比,3D-MPs负载不同抗肿瘤药物及在多种肿瘤模型上均证实其抗肿瘤作用显著增强。进一步发现载药3D-MPs在肿瘤部位高度富集,且通过多种肿瘤模型(体外3D球模型、皮下瘤模型、肿瘤皮窗模型及斑马鱼肿瘤模型)证实3D-MPs具有更强的穿透肿瘤血管进入肿瘤深部的能力,且更容易被TRCs摄取。
利用原子力显微镜测定MPs的杨氏模量发现,与2D-MPs相比,3D-MPs更加柔软,更易变形。MPs蛋白质组学研究发现骨架蛋白cytospin-A等参与了MPs的软硬度调节。通过小分子化学药物或cytospin-A siRNA调节MPs的软硬度证实软硬度直接影响载药MPs的体内过程及抗肿瘤作用。
该研究揭示了纳米药物的力学特性对其PK(Pharmacokinetics,药物代谢动力学)、PD(Pharmacodynamics,药物效力动力学)行为的深刻影响,为发展抗肿瘤药物的高效递送系统提供了新的思路。
据悉,华中科技大学生命科学与技术学院博士生梁清乐、别娜娜及博士后雍土莹为该论文的共同第一作者。人工智能与自动化学院石晓龙教授、生命科学与技术学院贾海波教授等参与了该项研究。生命科学与技术学院汪宁教授和武汉光电国家研究中心张智红教授等给予了有益的讨论和帮助。
参考文献:
1.Guillemard, V. & Saragovi, H. U. Novel approaches for targeted cancer therapy. Curr. Cancer Drug Targets 4, 313–326 (2004).
2.Wang, M. & Thanou, M. Targeting nanoparticles to cancer. Pharmacol. Res. 62, 90–99 (2010).
3.Zuo, Z. Q. et al. Promoting tumor penetration of nanoparticles for cancer stem cell therapy by TGF-β signaling pathway inhibition. Biomaterials 82, 48–59 (2016).
4. Axelson, H., Fredlund, E., Ovenberger, M., Landberg, G. & Pahlman, S. Hypoxia induced dedifferentiation of tumor cells—a mechanism behind heterogeneity and aggressiveness of solid tumors. Semin. Cell Dev. Biol. 16, 554–563 (2005).
5.Tang, K. et al. Delivery of chemotherapeutic drugs in tumour cell-derived microparticles. Nat. Commun. 3, 1282 (2012).
6.Ma, J. et al. Reversing drug resistance of soft tumor-repopulating cells by tumor cell-derived chemotherapeutic microparticles. Cell Res. 26, 713–727 (2016).